生命現象の理解と医療・産業利用のためのタンパク質科学
タンパク質の機能を解明する研究
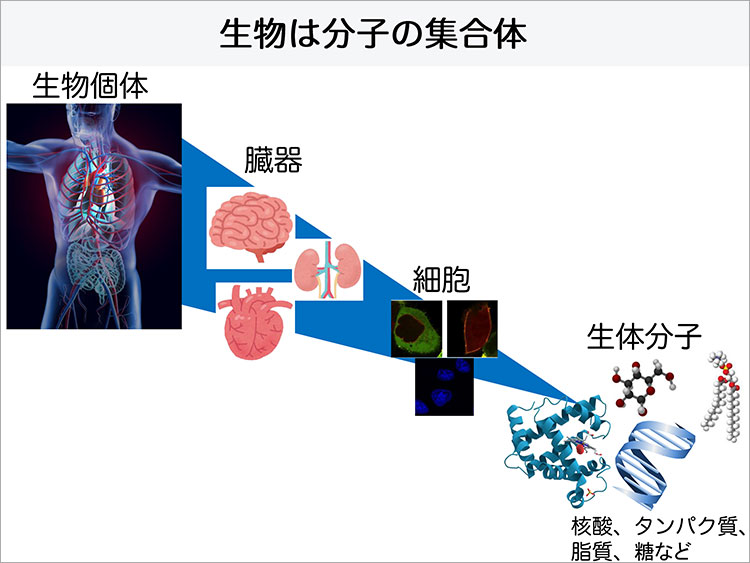
みなさんは、生物などのかたちあるものは全て分子の集合体でできているということを知っているでしょうか。私たちの身体は、核酸やタンパク質、脂質、糖などの生体分子が働くことで細胞の機能を発揮させ、それが臓器の働きとなり生命活動に結びついています。
松村准教授は、タンパク質科学(Protein Science)を専門とした学問分野でタンパク質の働き(機能)を分子レベルで解析し、生命現象の理解と医療や環境、バイオテクノロジー産業への応用を目指し、研究をしています。
タンパク質というものは、20種類のアミノ酸がペプチド結合で多数つながって構成されてできた、すべての生物が持っている重要な生体高分子で、炭水化物、脂質と共に食品に含まれる3大栄養素の1つとして、私たちが健康的な生活を送るためには欠かせない存在として知られています。食物から摂取したタンパク質は、一度胃で消化され、アミノ酸やアミノ酸が少数つながったペプチドとして腸から吸収され、私たちの身体を構成するタンパク質の素材として使われます。人の身体の構成成分の約70%は水分であり、タンパク質は水に次いで多く約15%を占めるとされており、タンパク質から筋肉、内臓、皮膚、髪などが作られています。
タンパク質は英語で「プロテイン(Protein)」と表記します。その語源はギリシャ語で『Proteios: 第一となるもの・最も重要なもの』という意味があり、このことからも、タンパク質というのは生物にとって必要不可欠なものであることが伺えます。私たちの体内には、タンパク質がなんと約10万種類以上、そして自然界では約100億種類も存在するといわれています。それはウイルスよりも小さい10-9(nm:ナノメートル)という本当に小さな分子ですが、それぞれが決まった固有の機能を持っていて、生物の生命活動を支えています。
多様な機能を有するタンパク質
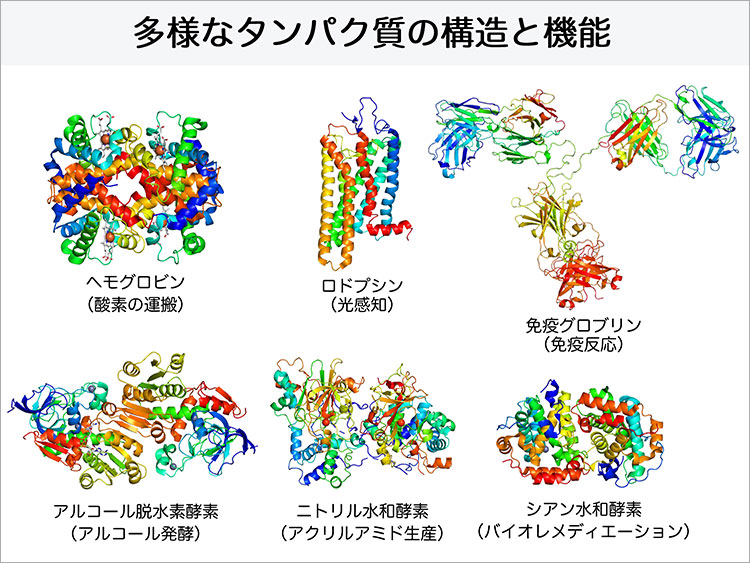
生命活動を支えているタンパク質の機能は様々です。ここでその機能について、少し紐解いてみましょう。例えば、タンパク質の働きとして、血液中での酸素の運搬があります。赤血球の働きは、肺で取り入れた酸素を筋肉などの各組織へと運ぶことです。赤血球中には「ヘモグロビン」というタンパク質が存在しています。このヘモグロビンが酸素分子と直接結合して運搬役として働きます。ヘモグロビンのような運搬タンパク質の他に、センサータンパク質があります。「ロドプシン」という光を高感度で感知するセンサータンパク質は、私たちの眼の網膜に存在していて、光を受けると電気信号が発生し、視神経から脳へ伝える働きをします。この働きによって暗闇でも順応したり、物を見たりすることができます。
また、最近免疫という言葉をよく耳にしますが、ウイルスや細菌などの体内に入った異物を除去する免疫機構でも、タンパク質は大きな役割を果たしています。異物が体内に入ると、侵入した異物にある抗原に特異的に結合する「免疫グロブリン」というタンパク質(抗体)が作られ、異物が排除されます。

さらに、身体の中の代謝では、連続的に多くの化学反応が進行しています。この化学反応を触媒するという大切な働きを行っているのもタンパク質です。特定の分子(基質)に対する化学反応の反応速度を大きくし、自身は反応前後で変化しない、いわゆる触媒として働くタンパク質は、「酵素」とよばれています。一般的に化学反応は、常温、中性の穏やかな条件では起こりにくいですが、酵素の働きによって、私たちの体内のような穏やかな条件下で代謝が行えるのです。
これらはタンパク質の多様な機能の例の一部ですが、このように私たちの身体のあらゆるところにタンパク質は存在し、千差万別の働きをしています。さらに、それぞれのタンパク質は単独で働いているわけではなく、様々な機能を持ったタンパク質が複雑に相互に関係(相互作用)することで、細胞の機能が調節され、生命活動が維持されているわけです。そのため、タンパク質の機能の解明は、生命の仕組みの理解につながる大きな意義をもった研究と言えます。また、タンパク質の働きの異常によって起こる病気も多いため、病気の治療法を開発する上でも、タンパク質の機能を解明する研究は重要と言えます。
さらに、酵素はまだタンパク質の存在も明らかになっていない古くから、産業利用もされてきました。身近な例として、酒やパン、チーズ、味噌、醤油などの発酵食品があげられます。近年では、自然界の微生物の酵素を利用して、アクリルアミドなどの化学品の合成を行う産業利用や、ダイオキシンやシアン化合物などの有害物の分解を行う土壌汚染の洗浄への利用(バイオレメディエーション)に向けた研究が行われています。
このように、動植物や微生物が持つタンパク質、酵素を上手く利用して食料や有用物質を生産すること、汚染物質を分解することにも、タンパク質の研究は広く貢献しています。
密接な関わりを持つタンパク質の立体構造と機能
冒頭に記述した通り、タンパク質はアミノ酸が多数つながって構成されていますが、そのアミノ酸の配列状態によって、形(立体構造)が異なります。タンパク質の構造は、アミノ酸がつながったポリペプチド鎖を1次構造、1次構造が部分的に折りたたまれ、らせん状やシート状の構造を作ったものを2次構造、2次構造が複数折りたたまれたものを3次構造と呼びます。さらに、3次構造をとった複数のポリペプチド鎖が集合すると4次構造となります。
タンパク質の立体構造と機能の間には関連性があり、タンパク質が多様な機能を有するのは、それぞれのタンパク質が固有の立体構造を持っていて、その機能に適した立体構造をとることができるからです。タンパク質の適切な折りたたみと立体構造は、精巧に調節されています。そのため、例えば1次構造で配列が1つでも異なると正常な立体構造が作られず、本来の働きができなくなって、病気の原因になってしまうこともあります。
タンパク質の機能を正確に理解するには、構造を見ることでわかることが多く、松村准教授はタンパク質の構造解析手法も用いて研究に取り組んでいます。
「タンパク質の働きを知ることができれば、『生命の仕組みとは何か?』という疑問の一端を解明することに繋がると思い、研究をしています」
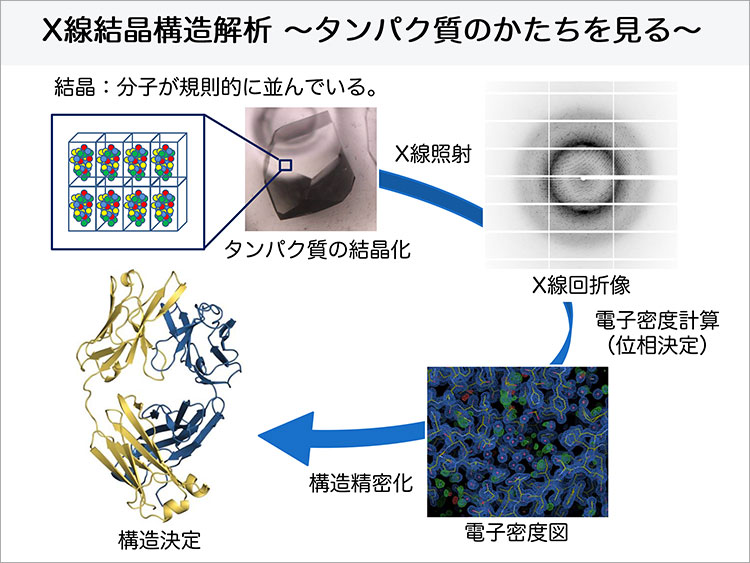
タンパク質のようなナノレベルの小さな分子の立体構造を、光学顕微鏡で観察することは不可能であり、X線結晶構造解析が最適な手段の1つだとされています。
X線結晶構造解析では、光学顕微鏡で利用する可視光よりも光の波長が短いX線を使うことで0.1nm程度といった原子レベルの解像度(分解能)で、タンパク質の立体構造を観察することができます。X線結晶構造解析を行うためには、タンパク質の結晶を作る必要があります。結晶というと塩や金属を思い浮かべると思いますが、タンパク質のような高分子も、塩のように結晶になります。ただし、タンパク質は柔らかく壊れやすいため扱いにくく、しかも結晶にするための最適な溶液条件を探すことは、相当な努力と時間が必要となる作業です、と松村准教授は話します。
この解析手法では結晶が高品質であることが鍵と言えます。X線を物質に照射すると、物質中の電子によってX線が散乱されます。X線が散乱する確率は、各原子が持つ電子の数が多いほど高くなります。個々の原子から散乱されるX線の強度は小さいので、それを直接観測することは難しいのですが、結晶を作って原子や分子に規則性をもたせて配置させると、ここの原子から散乱されたX線同士が干渉しあい、特定の方向に強く散乱されるため、観測することが可能になります。この現象をX線回折と呼び、回折X線の方向や強度から原子の並び方を決めることができます。結晶に多方向からX線を照射して、回折により生じる斑点の位置と色の濃さを計測したデータを収集し、それをコンピューターで解析することによって、ようやくタンパク質の立体構造を見ることができるのです。こうしたタンパク質の構造解析の手法を活用することで、松村准教授の研究はさらに医薬品の分野へと展開します。
医薬品ターゲットタンパク質の構造解析と創薬

医薬品の多くは、ターゲットとなる生体分子に結合することで効果を発揮します。例えば、酵素は基質となる分子の形を識別することで、特異的に基質と結合し化学反応を効率化しています。これは、鍵と鍵穴の関係にたとえることができます。
酵素をターゲットとする医薬品の場合は、タンパク質の鍵穴にピッタリとはまるような医薬品の鍵を設計することで、反応を妨げる薬ができます。また、逆にタンパク質の機能を促進するような薬の鍵を設計することも可能です。このように医薬品は、タンパク質の働きを調節することで、症状をコントロールさせているのです。また、医薬品を設計する上で重要なのは、ターゲットではないタンパク質の機能に影響を与えないことで、それにより副作用を極力少なくするということにつながります。そのためには、タンパク質の構造と候補となる薬剤化合物との結合の仕方が決め手となると松村准教授は言います。
創薬のプロセスに、何万種類もの化合物から、目的の疾患原因タンパク質に結合する薬剤候補化合物を探索し、絞り込むスクリーニングがあります。このスクリーニング手法にも、タンパク質の立体構造情報が活用されています。いわゆる「in silicoスクリーニング」と呼ばれる手法ですが、ターゲットタンパク質の立体構造と多数の薬剤候補化合物の構造を用いて、コンピューターでシミュレーションし、薬剤がターゲットタンパク質のどの部位にどのように結合しうるのか、またその結合の強さがどの程度であるのかを予測します。また、絞り込んだ薬剤候補化合物の構造を、ターゲットタンパク質の立体構造情報をもとに最適化する「Structure Based Drug Design(SBDD)」等も知られています。
X線結晶構造解析で得られるタンパク質の立体構造は、結晶中に含まれる分子の平均像であり静止した状態ですが、実際には、タンパク質は多くの水分子に周囲を囲まれており、熱運動で揺らいでいます。また、タンパク質が柔軟性を持ち、化合物との結合の際には結合に適した構造へと変わるため、これらの動きを考慮することも、効果的な薬剤を設計することには重要です。これらの構造変化は、分子動力学シミュレーションにより、予測することができます。人工知能(AI)や分子シミュレーションの技術の発達により、それらの技術を駆使した「in silico創薬」は、創薬の効率化に繋がる技術として大いに期待されていると松村准教授は言います。
タンパク質と薬剤の相互作用解析から新しい作用機序の解明
松村准教授と同じく理工学部の疾患生物学研究室の涌井秀樹教授は、秋田大学医学部附属病院でのリウマチ専門医としての経験から、広く使用されてきた既存薬が予期しなかった薬効を示すのは、ターゲットとして知られているタンパク質と違うタンパク質に作用しているためではないかと長年考えておられました。松村准教授が理工学部生命科学科に着任したことをきっかけに、松村准教授と涌井教授は既存薬の真のターゲットタンパク質を発見し、薬の作用機序解明を行うために、共同研究を開始し現在に至っています。
松村准教授がこの研究のターゲットとした既存薬の一つに『メトトレキサート』という関節リウマチの免疫抑制剤があります。関節リウマチは全国の人口の60~100万人と罹患率が高く、自己免疫疾患という自分の抗体が自分の細胞を攻撃することで関節の滑膜に炎症が起き、軟骨が破壊されていく疾病です。根本的な疾患原因は不明ですが、遺伝的、環境的なものが要因とされています。関節リウマチは治療期間が長く、QOL(生活の質)低下を招くこと、高齢化に伴い高齢発症が増大傾向にあることから、罹患者は介護対象になる可能性が高いとされ、今後の社会問題になると言われています。
関節リウマチの治療は、長年、痛みを抑制する対処療法が主体であり、進行を阻止することはできない病だと考えられていましたが、メトトレキサートが開発されたことにより、大きく変わりました。メトトレキサートは抗がん剤として開発された薬剤でしたが、低用量で投与すると炎症を抑え、関節リウマチに対して高い骨破壊進行抑制効果を示すことが判明し、関節リウマチの第一選択薬、アンカードラッグとして広く用いられるようになりました。1999年に、日本でも関節リウマチの治療薬として保険適用が認められました。メトトレキサートによる治療が可能になり、関節リウマチの治療は寛解を目指せるようになりました。しかし、なぜメトトレキサートは関節リウマチに対して高い治療効果が現れたのかということは解明されていないといいます。すでに臨床利用は行われていますが、松村准教授は科学的根拠に基づいた医療(Evidence Based medicine)に資するために、正確な作用機序を解明することで、より有効的で副作用も抑えられる治療が確立できるのではないかと考え、メトトレキサートの新規ターゲットタンパク質の探索と解析の研究を始めることになったのです。
松村准教授は酵素と基質間の結合のような特異的な相互作用を利用してタンパク質の分離を行うスクリーニング方法であるドラッグアフィニティークロマトグラフィー法を用いて、メトトレキサートの新規ターゲットタンパク質の探索を行いました。その結果、メトトレキサートに特異的に結合する炎症反応に関わるあるタンパク質が発見されたといいます。松村准教授はこの炎症反応に関わるタンパク質に着目して、メトトレキサートとの構造解析と相互作用について研究を進めています。
メトトレキサートの抗リウマチ薬としての作用機序の解明をめざす
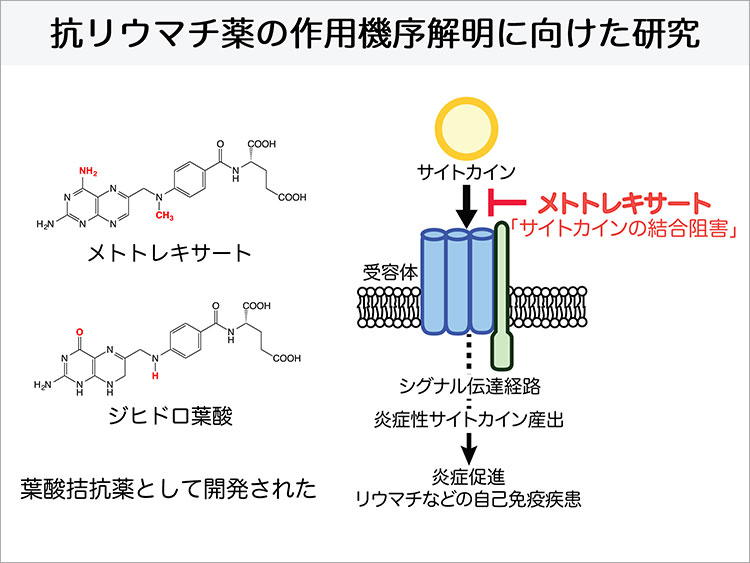
ドラッグアフィニティークロマトグラフィーを用いたスクリーニング解析により発見されたタンパク質は、「サイトカイン」という炎症反応を引き起こす作用がある分子であることがわかりました。メトトレキサートは炎症を抑制する薬であることから、ターゲットタンパク質としての関係性が見えてきたといいます。関節リウマチ患者の体内ではこのサイトカインの発現量が多く、またその遺伝子が働かなくなると炎症反応が抑えられるという報告がありました。松村准教授はこれにより、メトトレキサートは、このサイトカインの働きを阻害することで、関節リウマチの炎症を抑えているのではないかと考えたのです。
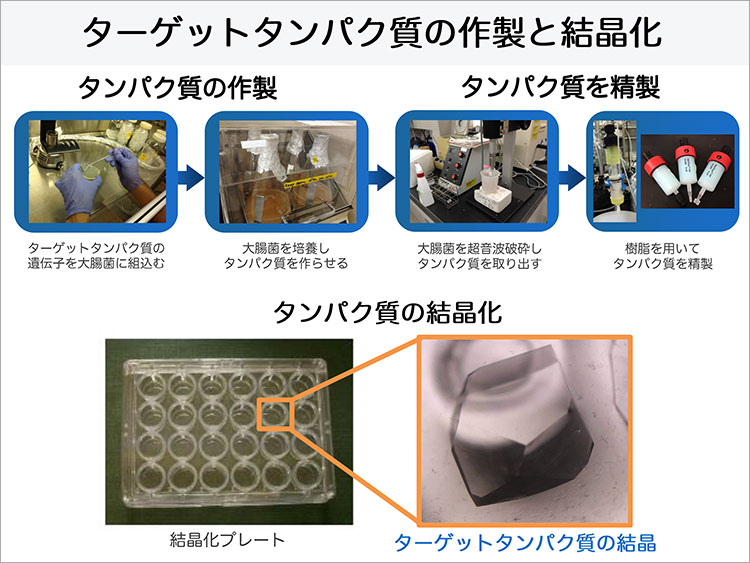
松村准教授は大腸菌を使って発現させたサイトカインを用いて、X線結晶構造解析と熱力学的測定でメトトレキサートとの結合親和性を検証しました。メトトレキサートとサイトカインは1:1 の分子の比で結合することが実証されたそうです。さらに、メトトレキサートがサイトカインに結合している構造をX線結晶構造解析でも見ることができ、メトトレキサートがどのように結合するのかという結合様式も初めて明らかにしました。
加えて松村准教授は、このサイトカインと受容体タンパク質が結合した場合、メトトレキサートはどのように結合を阻害し、どのように影響を与えるのかという実験も行いました。分子動力学シミュレーションを用いて、メトトレキサートが結合した場合としていない場合のエネルギーがどのように変化するかを調べたところ、メトトレキサートが結合すると結合エネルギーが不安定化することがわかったそうです。これによりメトトレキサートとこのサイトカインが結合した場合、その受容体タンパク質と結合しにくくなるということが明らかになりました。
「メトトレキサートをさらに高い親和性で結合させるように改良することが可能になれば、抗リウマチ薬としてさらに効果のある薬に改善できるようになるでしょう」と松村准教授は語ります。
医療や産業に導く研究で社会に貢献する

松村准教授は、高校生の時に「羊のドリー」というクローン羊に興味を持ち生命科学系の大学へ進学し、そこで構造によって機能が変わるタンパク質についての研究を始めたといいます。
生物の遺伝子情報は現在までにほぼ解明されていますが、遺伝子の役割やタンパク質の構造や機能についてはまだ解明されていないことがたくさんあるそうです。
松村准教授の研究室には、基礎研究や生命化学、医薬系に興味を持つ学生が多く集まっています。学生の卒業後の就職先も医薬系、食品開発、品質管理系、バイオ産業など多方面に渡り、また大学院に進学して研究技術を磨く学生もいます。松村准教授の研究は、現在も学生たちに受け継がれ、それぞれがそれぞれの分野で活躍しているのです。
「タンパク質解析は病気の予防や治療、創薬、基礎的研究から、さらに進化工学的手法などを用いた産業利用として社会に貢献する研究だと思います」と松村准教授は言い、これからも『第一となるもの・最も重要なもの』であるタンパク質の機能解明に向けて研究は続いていきます。
研究室の学生の声
大学院理工学研究科 生命科学コース 修士1年
江澤 理徳 さん

僕が秋田大学理工学部に入学を希望したのは、理学と工学にそれぞれ特化した分野の研究だけではなく、併せ持った研究ができると思ったからです。さらに僕は高校生の時から化学と物理の勉強が好きで、医薬品や生物学にも興味がありました。
松村先生の研究室は化学と物理の両方の知識を兼ね備えながら生物探究ができるので自分にはピッタリだと思い、この研究室に入りました。今後は松村先生が研究されている関節リウマチの免疫抑制剤メトトレキサートについて、タンパク質の研究を続けたいと思っています。
この学部の約7割は県外から来たという学生で、僕自身も研究はもちろん、プライベートも充実した学生生活を送っています。生命科学関連の分野に興味のある方は、ぜひ理工学部で一緒に研究しましょう。
(取材:広報課)
※掲載内容は取材時点のものです



