基礎研究で人体の正常と異常を見極め、がんのメカニズムを解明する
病理医のお仕事って?

吉岡教授は現在、秋田大学医学部保健学科に在籍していますが、以前は消化器外科医として働き、大学院へ入学して医学で使用する様々な実験方法を学んでいたといいます。肝転移で亡くなる患者さんを多く看取っていた吉岡教授は、この頃大学院の博士研究のテーマとして大腸がんの肝転移のメカニズムを研究していました。
大学院卒業後も外科医として働いていましたが、このがん研究を継続し、がんに対する病理学的なアプローチを学びたいという思いが強くなったことから、外科医となって10年目に病理医へ転向したのです。そして実験病理や病理診断、病理解剖を学び、マクロレベルだけでなく、ミクロレベルや分子レベルでの病理学的視点に立った考え方を多く学んだといいます。
吉岡教授の病理医としての仕事は、内科医が内視鏡で「ポリープ」と呼ばれるいぼのようなものなどを探し出して採取したものが、良性か悪性かを顕微鏡で観察し診断することです。他にも、手術で採取した標本を顕微鏡で見てチェックし、病気の状態をレポートにまとめて外科医に提出しています。内科医や外科医はそれを見て次の段階の治療を加えるか否かの判断をしていきます。
つまり、患者さんの検体ががんかどうかの判断をし、診断の基盤となるデータを作成するのが病理医の主な仕事です。病理医は直接患者さんと接することはほぼありませんが、病理医が確定診断をして初めて、がんやその他の病状が診断されるという医療体制の中で非常に重要な役割を担っています。
異常の見極めは正常の理解から

保健学科は1年次では解剖学や組織学で正常な人体構造について学び、2年次の病理学ではそれが病気になった時、つまり人体の構造や機能が異常をきたす際の変化やそのメカニズムを学ぶようになっています。このように、吉岡教授は、しっかりと病気のメカニズムを学べるように、基礎医学を学ぶ学部の1年次から2年次にかけて、正常から異常への繋がりを持った教育を日頃から心掛けています。
秋田大学保健学科は、「看護学専攻」とリハビリ分野の「理学療法学専攻」と「作業療法学専攻」に分かれており、どれも医療に従事する専門職を目指します。そのためどちらの専攻でも病気をしっかりと理解するということが大切なのです。リハビリ職である理学療法士や作業療法士は、実際に患者さんと接して筋肉の状態などを全てチェックする必要があるため、保健学科の「理学療法学専攻」と「作業療法学専攻」には、1年次の後半に実際に人体の系統解剖を行い勉強する機会が設けられています。
また、学生は、医療専門職者を対象に解剖実習が終了した18時以降に行われている、解剖実習体を用いた「解剖学の学び直し講座」の期間中に、実習体に触れて学ぶことが可能であり、その際はまた、実際に医療に従事している方からも、臨床的に大事な部分を教わるなど貴重な経験をしています。解剖実習のない看護学生にとっても、実際の実習体を通して人体構造を学べる大切な機会になっています。
「秋田大学保健学科の人体の解剖実習が始まって30年以上経ちますが、理学療法士と作業療法士の養成校で系統解剖実習が行われている大学は全国でも30%ほどしかありません。医学科と献体にご協力いただける組織(秋田大学では白菊会)がなければ成り立たないため、秋田大学での解剖実習は貴重な体験といえます」
がんって何?
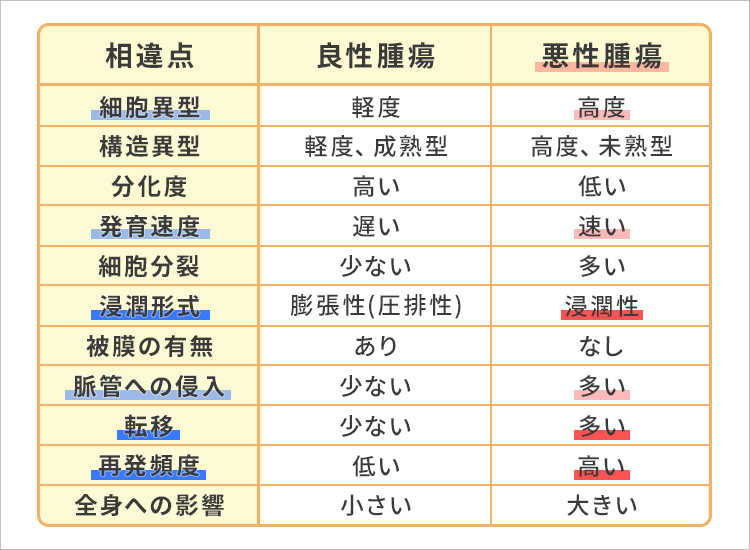
良性腫瘍と悪性腫瘍の比較
がんといえば腫瘍という言葉をよく耳にすると思います。腫瘍というのは、身体を構成する細胞が意思を持っているかのように自律的に過剰に増殖したものです。がん、すなわち悪性の腫瘍は最終的にその人の身体を壊して死に至らしめてしまいます。
では、良性腫瘍と悪性腫瘍はどのようにして見分けることができるのでしょうか。前者は周囲の細胞を押し出すように膨張して組織されていきます。ところが後者になると正常と異常の境界がわからなくなり、腫瘍細胞が周囲の細胞間へ細かく入り込みながら増殖してしまう浸潤性発育が起きてしまうのです。そのため、再発の頻度は悪性腫瘍のほうが高く、原因として取りきれなかったがん細胞が大きくなり再発するケースがほとんどです。
がんは、遺伝子(DNA)異常の蓄積による病気といわれています。発がん性物質によるDNA傷害やDNAの修復機構の異常から、また、メチル化などのエピジェネティックな機構の異常からも起こります。DNAの遺伝子情報はメッセンジャーRNAに伝えられ、その情報をもとにタンパク質が合成されますが、DNAに異常があるとそこから異常なタンパク質ができ、腫瘍やがんが発生してしまいます。
また、もともと正常な細胞の増殖に関するプロトオンコジーンといわれる遺伝子に異常がもたらされると、がんに対してアクセルの働きをするオンコジーン(がん遺伝子)に活性化されてしまい、がん化に繋がります。これに対しがん抑制遺伝子(サプレッサージーン)は、がん化に対してブレーキの働きをしてくれます。細胞には自分の役目を終えると自ら死んでしまうアポトーシスという現象があり、がん抑制遺伝子には細胞の増殖を抑制したり、異常な細胞をアポトーシスによって排除するものがあります。これらは多くのがんで発現し、がん遺伝子が活性化されてアクセルが踏まれたり、がん抑制遺伝子のブレーキが壊れてしまうと、がんはどんどん大きくなってしまうのです。
がんの転移にも種類がある
がんの転移には大きく分けるとリンパ行性転移、血行性転移、播種性転移の3つがあります。リンパ行性転移は、がん細胞がリンパ管の中に入り転移することをいい、血行性転移はがんが毛細血管や静脈内に入り、血流に乗って離れた臓器などで増殖し転移巣をつくることで全身に広がっていくことをいいます。そしてこれはがん細胞が最初に到達する臓器で増殖するなど、解剖学的な構造により転移先がある程度決まっています(メカニカルセオリー)。播種性転移は、内臓の内側から発生し大きくなって壁を破って外に頭を出したがんが、擦れることで種を蒔くようにバラバラと胸腔内や腹腔内へ広がっていくことをいいます。
転移がん細胞は、がん細胞の中でもエリートと言っていいほどさまざまな能力を持ち、私たちの健康を奪っていきます。また、転移が肺や肝臓など重要な臓器に起こってしまえば、患者さんの予後にも大きな影響を与えてしまいます。がんは本来局所的な病気ですが、転移してしまうと全身の病気となってしまうため、吉岡教授はがんの治療は、転移が発生する前の早期の治療が重要だと話します。
がん細胞が転移して増殖する条件
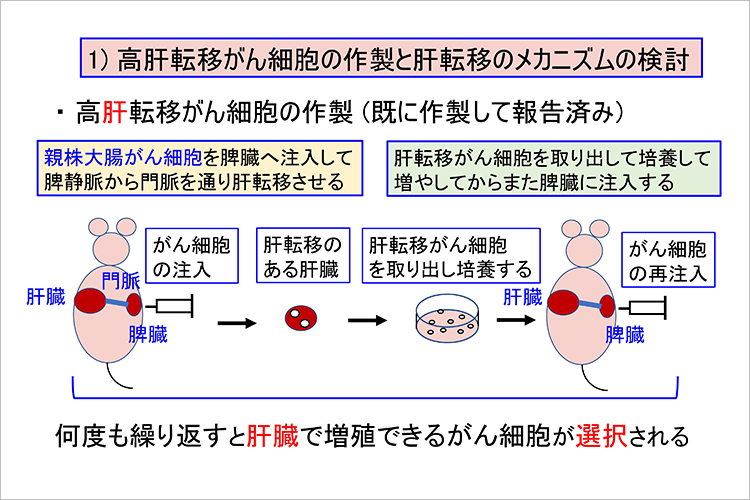
この方法で高肝転移がんの細胞モデルを作り、メカニズムを検討した
吉岡教授が現在行っている研究は主に3つです。1つ目は『がんの臓器特異性転移のメカニズムの解明』、2つ目は『肝臓の細胞が出すHeregulin(HRG)という物質を産生するメカニズムの解明』、3つ目は『インテグリンβ4という分子ががんの進展に及ぼす影響の検討』です。
前述した「メカニカルセオリー」とは異なる「Seed and Soil(種と土壌)セオリー」について吉岡教授が主に研究しているのが1つ目に挙げた研究です。がんの転移先はある程度決まっていますが、吉岡教授は機械的にがん細胞が臓器へ到達しても必ずしもがん細胞が増殖するとは限らないのではないか、つまり、がん細胞と転移先の臓器になにか特異性があるのではないかと考えています。
この研究は転移しやすい細胞のモデルを作ることから始まり、マウスを使って実験を行います。親株の大腸がん細胞をマウスの脾臓に打つと門脈行性に肝臓に到達し、肝臓の環境で生きられる細胞だけが残り増殖していきます。そして転移した肝臓に白いがんの転移結節ができたら採取・培養し、転移したがん細胞をまた脾臓に注入して肝転移させることを繰り返します。この作業を何度も繰り返すことで肝臓で増殖できるがん細胞が選択されるという仕組みです。そうして親株のがん細胞と肝転移を繰り返して転移がたくさんみられた高肝転移がん細胞の性質を比較します。吉岡教授はこの実験について、
「できるだけ実際のヒトのがん転移の状態に近づけるためには、このマウスでの実験は必要です。そしてこの実験を行うことで転移に関わる重要な結果が得られることを期待しています」と話します。
吉岡教授はこの研究で大学院生の時に消化器がんの進行とともに増加するCEA(carcinoembryonic antigen; がん胎児抗原)が、高肝転移がん細胞で発現が上昇することを知りました。CEAはがんの存在を示唆する腫瘍マーカーのひとつで、血液中のCEA数値が上がってくるとがんがある可能性が高くなります。CEAの特徴としては、細胞表面に発現してCEA同士で結合する働きがあります。CEA同士が結合するとがん細胞が互いに結合して集まり、塊を作りやすくなるといいます。これは肝臓の毛細血管である類洞に詰まりやすくなり、類洞を損傷させて転移の足場を作ることを可能にしています。さらに、がん細胞が集まることで免疫の攻撃から逃れることができるがん細胞も増えてしまいます。
現在、高腹膜播種細胞や高肺転移細胞などを作製中で、これらのがん細胞の特徴を知ることで、臓器特異性転移のメカニズムの解明につながるのではないかと考えています。
正しい結果を導き出すために
HRGが肝細胞に及ぼす影響
2つ目の研究では、肝転移実験から、がん細胞が持つ「ErbB3」という受容体が活性化するためにはHeregulin(HRG)という増殖因子が必要であり、この増殖因子を肝細胞が産生しているということがわかりました。がん細胞は、転移先の肝細胞が出すHRGによって、ErbB3、および、これとペアを作るErbB2(HER2)が活性化されて遊走や浸潤しやすくなります。しかしながら、吉岡教授は肝臓が自らを傷害させる転移したがん細胞を生き延びさせるHRGをなぜ産生しているのか不思議に思ったといいます。
「研究を続けていくうちに肝細胞そのものも、ErbB3を持っていることがわかりました。そして肝細胞は傷害などを受けて死んでしまうと、肝細胞を増やそうと周囲の肝細胞が増殖因子であるHRGを産生するのです。つまり、がんが肝細胞を壊した場合、肝臓が自らの再生のために産生したHRGを転移したがん細胞は利用してさらに浸潤して増殖していくのです」
吉岡教授はHRGがどのように肝細胞に影響するのかなど、より深いメカニズムの解明に努めています。
インテグリンβ4のはたらきと今後の実験

また、3つ目の研究で吉岡教授はインテグリンβ4が前立腺がんや乳がんの進展に関与しているということ報告しています。しかし実際はそれだけではなく、インテグリンβ4は様々ながんに発現しており、膵がんでも見受けられるそうです。
インテグリンβ4は細胞に発現して、細胞が細胞の外にある基質のラミニンと接着する際に働きます。細胞の外からの情報を細胞内へ伝えるとともに、がん遺伝子のErbB2などを活性化します。
吉岡教授は「インテグリンβ4が膵がんの発生や進展にどのような影響を及ぼしているのかをマウスなどを利用して検討したい」と語ります。
現在は遺伝子や様々な分子の変化がわかるようになってきたため、以前に比べると新しい変化を持ったものが発見できるようになり、それが特異的な影響を及ぼすこともわかるようになりました。これまで吉岡教授が立ててきた仮説も実験で証明された時には喜びを感じつつも、それが本当に正しい結果なのか、更なる追試や別方向からの実験も必要だといいます。正しい結果を導くためには正しいステップで正確な実験を行うことが大切で、そうした段階を踏んでバージョンアップしていくことでようやく物事の本質を捕まえることができるのです。
諦めずに視野を広げることが大切です
吉岡教授は保健学科で看護学・理学療法学・作業療法学の全ての学生の教育に携わっていますが、これらの医療専門職の教育機関で基礎研究を行っていることは珍しいことだといいます。医療従事者や医療専門職に就く人は科学に興味を持っている人が多く、保健学科には基礎研究に興味を持つ学生も少なからず在籍しています。
自分が置かれた環境で、本当にやりたかったものが違うものであったりすると、勉強に興味を持てなかったりすることがありますが、実はよく調べると今置かれている環境の中にも、自分自身がやりたかったことが隠れていたりすることがあると吉岡教授は言います。将来の目標に向かって関連性の高いものを学ぶのは大切ですが、それだけを学ぼうという姿勢ではなく、できるだけ広い視野を持つことで、興味のあるものをまだまだ見出せる可能性を秘めているのです。
そして、何か初めてのことをやろうとする時は時間がかかり大変だと思ってしまいますが、しっかりと準備をして一生懸命頑張ってみると、思ったほど時間はかからないことがあります。
吉岡教授自身も外科医から病理医へと進む方向を変えた時、尊敬する外科の教授から「何事も訓練の積み重ねです。訓練すれば大丈夫、できないことはありません。頑張りなさい」と声をかけられたそうです。その言葉は今も吉岡教授が何か新しいことに向かう際の支えとなっているそうです。

「興味を持ったことには諦めずに取り組み、もしかしたらできるかも知れない、という気持ちで頑張ることで、それが何かに繋がっていくと思います。将来の進路についても、希望するものがあれば諦めずにそれに向かって進んで行って欲しいです。自分の可能性を狭めず、少しでも広げていけるように頑張ることが大切です。
自分に直面する一つ一つは自分を成長させるために必要な訓練のようなものだと思って臨むことで、結果が少しずつついてくるように思います。すぐに結果が出なくても、のちに役立つこともありますので高校生の皆さんには頑張って臨んでほしいですね」
秋田大学医学部保健学科には吉岡教授が顧問の「科学研究クラブ」という課外クラブがあります。そこには学生のうちから研究者として学ぶ機会や環境を作っていきたいという吉岡教授の思いが込められています。そこでがんの研究に興味を持った学生たちが大学院へと進学し、現在吉岡教授と共にがんを中心とした基礎研究を行っています。
吉岡教授のがん研究は、未来の医療、そして今後の私たちの助けになっていくことでしょう。
(取材:広報課)
※掲載内容は取材時点のものです



